Envie de corriger votre ADN ?
Exploration de nouvelles voies dans un paysage génétique en constante évolution
La biochimiste Jennifer Doudna présente une technologie de pointe qui utilise l’ADN pour corriger le génome humain. Cette avancée contribue aussi à la liste toujours plus longue de problèmes éthiques que les chercheurs doivent résoudre actuellement.
De la Grande Île d’Hawaï où elle a grandi, Jennifer Doudna avait l’habitude de contempler la longue courbe de l’horizon et l’immensité du ciel qui enveloppe ce minuscule lieu d’observation au milieu de l’océan. Cette vision, intimidante par ses dimensions, reste fascinante par ses possibilités : on y est quasiment perdu dans l’espace et pourtant l’infini est juste là, au-delà du visible, sous la surface, à nos pieds. Cette image correspond parfaitement à la découverte qui fait la réputation de J. Doudna. En effet, au cœur de la plus minuscule des cellules bactériennes, elle et son équipe ont découvert un portail vers un monde entièrement nouveau : dans la chimie qui permet aux bactéries de se rappeler et de découper l’ADN provenant de virus infectieux, elle a trouvé un outil pour éditer (corriger) les gènes.
Cela fait plusieurs décennies que l’on connaît des molécules qui découpent l’ADN (appelées enzymes de restriction), mais là, c’était quelque chose de nouveau : une enzyme que l’on pouvait programmer pour qu’elle coupe à un endroit spécifique. Venue du nulle part ou presque, cette avancée a ouvert une toute nouvelle fenêtre sur l’ingénierie génétique, apportant un niveau de précision et d’exactitude inaccessible jusque-là.
Dans un article de la revue Science paru en 2012, Doudna et ses partenaires laissaient entendre modestement qu’ils « proposaient une méthodologie alternative fondée sur un couple ARN-Cas9 programmée, présentant un potentiel considérable dans des applications de ciblage génétique et d’édition génomique ».
Connu sous le nom de CRISPR-Cas9 (ou simplement « crisper »), le procédé a effectivement pris d’assaut l’ingénierie génétique. Comme l’indique un récent article de synthèse, « CRISPR est rapidement devenu l’outil préféré pour les manipulations génétiques et se révèle incroyablement prometteur comme plateforme d’étude de la fonction des gènes in vivo ».
« Je suis très impatiente de découvrir à quel point l’ingénierie génomique pourra être bénéfique à la vie humaine et à notre compréhension fondamentale des systèmes biologiques », déclare Doudna. Mais quelle est la meilleure voie de progrès dans ce nouvel univers ?
« Il me paraît évident aujourd’hui que, pour accroître la confiance en la science, il vaut mieux encourager les gens impliqués dans la genèse d’une technologie à participer activement à des discussions sur ses utilisations. C’est particulièrement important à une époque où la science est mondialisée, où matériels et réactifs sont fournis par des centrales d’approvisionnement et où les données publiées n’ont jamais été accessibles aussi facilement. »
Jennifer Doudna est professeure de biochimie, biophysique et biologie structurale à l’université de Californie-Berkeley. Dan Cloer, l’un des collaborateurs de Vision, l’a rencontrée dans son bureau sur le campus.
DC Sur quoi porte le débat quand on parle de corriger une lignée germinale ? Comment le sommet international de décembre 2015 consacré à l’édition génomique chez l’homme a-t-il influencé vos perspectives ?
JD C’est quelque chose de tellement fantastique quand on y pense. Soudain, on réalise : « Incroyable ! On a un outil qui, dans le principe, permet de changer l’évolution humaine. On peut effacer une mutation présente dans toute une population, s’en débarrasser purement et simplement. »
Il y a les faits scientifiques et les réalités de la reproduction humaine, bien sûr. Alors, rien ne se passera du jour au lendemain. Mais globalement, nous disposons des outils pour modifier notre ADN et ce que nous transmettons aux générations futures. Désormais, nous pouvons prendre ces décisions. C’est une idée forte.
« Nous disposons des outils pour modifier notre ADN et ce que nous transmettons aux générations futures. Désormais, nous pouvons prendre ces décisions. »
La récente conférence n’a pas changé ces perspectives, elle les a élargies. D’un esprit plutôt ouvert, j’essaie d’apprendre et de comprendre. Je connais la science parce que je suis une scientifique, mais je m’efforce de saisir tous les autres points de vue sur le sujet. Le sommet était intéressant, car nous avons entendu un certain nombre de bioéthiciens et de personnes qui travaillent avec des patients et des familles présentant des désordres génétiques. J’ai discuté avec des gens qui ont ces maladies, avec des parents qui cherchent désespérément de l’aide. En tant que parent, je comprends parfaitement leurs attentes.
Le sommet a atteint un objectif déterminant, à savoir réunir des acteurs importants, pas seulement des scientifiques mais des personnes venues d’autres horizons (pas tout le monde, mais c’était un début). De ce fait, plusieurs opinions ont été exprimées, ce qui était formidable. De manière générale, il a été admis que la recherche devait se poursuivre, mais nous voulons continuer avec la prudence qui convient. C’est pourquoi notre déclaration, à la fin de la rencontre, appelait à un large consensus sociétal avant toute utilisation de cette technologie dans une application clinique quelconque sur une lignée germinale humaine. Mais comment définir « un large consensus sociétal » ? Cela reste à voir. Nos échanges ne sont pas terminés, ce n’était que le début.
DC À la fin du sommet, le langage employé a fait l’objet d’une discussion, impliquant qu’un glossaire serait nécessaire pour que les observateurs non initiés puissent accéder aux informations. J’ai eu l’impression que les « sommités » (orateurs et membres de l’assistance, pour reprendre l’appellation de David Baltimore) étaient les adultes dans la salle, et que le reste d’entre nous étions des enfants qui avaient besoin d’être instruits ou amenés à une certaine conclusion. Le public peut-il comprendre ce qu’il doit savoir ?
JD Cette question m’attriste un peu ; je n’ai absolument pas ce sentiment, et cette impression me désole. Nous vivons tous ensemble dans la même société et sur la même planète. Effectivement, certains d’entre nous sont experts en sciences et d’autres dans des domaines différents, mais nous avons tous notre place dans cette discussion. Je suis tout à fait novice dans ces autres domaines, tout comme on peut l’être en sciences. Je veux prendre part à la conversation, mais pas dicter ou dire à d’autres ce qu’il faut penser. Néanmoins, les scientifiques ont, de fait, un certain socle de connaissances.
La difficulté réside dans la communication de ces informations à des gens qui ne sont pas des experts techniques. La science passe en grande partie par la langue et nous sommes habitués à nos acronymes. À mon avis, il faut absolument que les scientifiques soient impliqués dans cette discussion, mais nous avons besoin de tous les autres autour de la table. Je veux que les gens pensent à tout cela en étant bien renseignés et en comprenant suffisamment les aspects scientifiques pour pouvoir réellement se faire une opinion. Je tiens simplement à m’assurer, en tant que scientifique engagée dans cette démarche, que je joue mon rôle en sensibilisant les gens, en leur expliquant ce que c’est, pour qu’ils puissent y réfléchir en connaissance de cause. Je ne veux pas leur dire comment penser, je veux juste leur dire : « Voilà ce qui se passe. Maintenant, à vous de décider ! »
DC Dans un article pour le magazine Nature, vous avez écrit que « le développement rapide et l’adoption généralisée de méthodologies d’édition génomique faciles à utiliser, peu coûteuses et performantes a changé le “paysage de la biologie”. » Étant donné que, pour les profanes, c’est extrêmement complexe, pouvez-vous nous dire l’essentiel de ce que cela signifie ?
JD Cela signifie que, désormais, nous avons un outil qui permet de réécrire le code génétique, de modifier l’ADN dans les cellules. Ce n’est pas rien. Il permet aux scientifiques de faire des choses qui, dans le passé, auraient été vraiment difficiles, voire impossibles. Quand je pense au « paysage de la biologie », j’englobe tout, pas seulement la biologie et la médecine humaines, mais aussi la biologie végétale, les champignons, le monde bactérien. C’est un territoire très vaste.
DC Y a-t-il aussi un côté obscur ? Dans quelle mesure pourrait-on facilement créer une bactérie résistante aux traitements ?
JD Ce serait difficile à faire, mais si un terroriste cherche à nuire, il existe des moyens beaucoup plus aisés. Ce n’est pas un sujet qui me préoccupe énormément. Quand on dit que c’est « un outil simple et pratique », tout est relatif. Si vous êtes biologiste moléculaire, c’est vraiment plus simple et plus pratique, mais ce n’est pas le cas pour une personne ordinaire. Les gens s’inquiètent du bioterrorisme, mais il existe des méthodes bien plus faciles pour créer des problèmes.
DC Il y a cinquante ans, le terme algénie a été conçu à partir de alchimie et de génie pour exprimer le scepticisme à l’égard des résultats qu’on pourrait atteindre en corrigeant la génétique. Les gènes nous fascinent-ils trop ? Où en sommes-nous de la compréhension de leur pouvoir déterministe ?
JD Les choses vont bouger au fur et à mesure de nos progrès. Aujourd’hui, nous connaissons un ensemble de gènes à l’origine de certains désordres monogéniques [provoqués par un seul gène défectueux : maladie de Tay-Sachs, drépanocytose, mucoviscidose, hémophilie, etc.]. Si nous étions capables de corriger ou de réparer ces mutations, nous savons que cela serait très bénéfique pour les patients. Mais il sera difficile de dépasser ce stade pour aller vers des pathologies beaucoup plus complexes, comme la schizophrénie, le trouble du spectre de l’autisme ou d’autres, qui impliquent de nombreux gènes (parfois une centaine ou plus, chacun y contribuant pour une petite part). Comment pourrait-on même envisager d’utiliser une approche par édition génomique dans ces cas-là ? Je l’ignore. La correction des gènes serait-elle même appropriée ? Nous n’en sommes certainement pas là actuellement, et nous n’y serons peut-être jamais.
Il existe toutes sortes d’autres choses dont nous ignorons totalement l’origine génétique. Néanmoins, je pense sincèrement que l’avenir nous apportera cette compréhension fondamentale. Je n’ai pas de calendrier mais je suis convaincue que les techniques d’édition génomique nous aideront à accéder à ces connaissances de base. D’avancée en avancée, nous serons capables de disséquer la génétique d’autres maladies ou traits héréditaires. Mais pour l’instant, en supposant que quelqu’un cherche concrètement à avoir cet enfant, plus grand et plus malin, doté de ce niveau d’intelligence, ce n’est pas comme si nous pouvions composer tout cela dans le génome.
DC Ce genre de progrès suscite une autre catégorie de questions, mais en ce qui concerne les maladies monogéniques, les réponses sont apparemment plus simples et pourraient être traitées.
JD Tous les problèmes ne sont pas résolus, c’est certain. Mais si nous pouvons apporter une réponse plus simple à l’un d’eux, c’est une énorme amélioration. Mes recherches concernent la technologie d’édition génétique, ainsi que les systèmes immunitaires bactériens. Nous collaborons avec des cliniciens dans le cadre de l’utilisation de cette technologie pour mieux comprendre la base génétique de certaines maladies, et nous espérons qu’à l’avenir, il y aura un réel bénéfice pour les patients. Je ne suis pas médecin, donc je ne m’occupe pas personnellement du volet clinique, mais je veux faciliter le travail de ceux qui le font. Ce sont tous des traitements de cellules somatiques [du corps] chez l’adulte, pas d’une lignée germinale.
« Tous les problèmes ne sont pas résolus, c’est certain. Mais si nous pouvons apporter une réponse simple à l’un d’eux, c’est une énorme amélioration. »
Je tiens à m’impliquer dans la discussion générale sur le sujet. Je ne vais pas me contenter de balancer le tout et laisser les gens s’en débrouiller. Il est juste de dire que je fais partie de cette discussion et j’ai un sentiment de responsabilité.
DC Quelle a été votre contribution à la découverte de CRISPR-Cas9 ? Comment fonctionne l’édition génique ?
JD J’ai travaillé sur CRISPR en collaboration avec Emmanuelle Charpentier en Allemagne. Nous nous sommes associées pour mieux comprendre la fonction moléculaire d’une protéine particulière, appelée Cas9, qui intervient dans le système immunitaire bactérien. Nos recherches ont révélé qu’il s’agissait d’une protéine guidée par l’ARN.
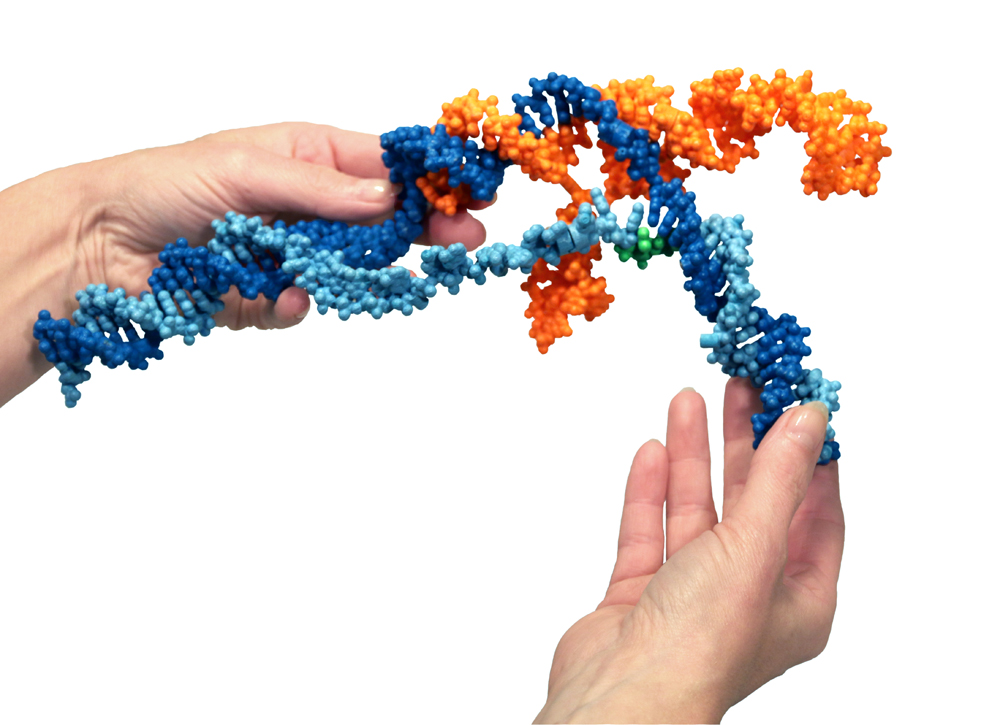
Maquette (plâtre et polymère) du Système CRISPR-Cas9, dessinée et imprimée par la société 3D Molecular Designs, en collaboration avec Jacob Corn, directeur scientifique de l’institut Innovative Genomics Initiative (Berkeley, Cal.).
Photographie : Shannon Smith, 3D Molecular Designs.
Voici une maquette. La protéine se lie à une molécule d’ARN [orange]. L’ARN se trouve à l’intérieur de la protéine. Ensemble, ils se glissent le long de l’ADN [bleu] de la cellule jusqu’à ce que les lettres génétiques de l’ADN et les lettres de l’ARN correspondent. C’est ainsi que l’ARN « guide » dans le système ; il cherche une séquence d’ADN spécifique. Lorsqu’il y a correspondance entre les vingt lettres de la séquence d’ARN et un segment d’ADN, la double hélice d’ADN s’ouvre (le filament bleu clair est séparé du bleu foncé et une hélice ARN-ADN se forme, à l’intérieur de la protéine). Les « ciseaux » moléculaires de la protéine coupent alors les deux brins d’ADN, en opérant une coupe très précise, comme au scalpel ; l’échelle d’ADN est découpée sur toute la longueur. Pour les bactéries, c’est une façon de combattre une infection virale.
Un autre mécanisme de la cellule répare la rupture. C’est au moment de la réparation que se produit l’édition sur l’ADN et que la séquence peut être modifiée. Cas9 a le rôle des lames de ciseaux mais ensuite, l’ADN coupé doit être transféré à d’autres protéines de la cellule qui catalysent la recombinaison. Ces enzymes réparatrices sont capables de trouver l’ADN à recoudre, éventuellement fourni par l’expérimentateur.
Ces molécules réparatrices sont connues depuis longtemps. L’idée était donc que, si l’on trouvait un moyen de briser l’ADN à l’endroit précis où l’on voulait introduire une modification, on pourrait contrôler les modalités de la réparation. C’était le défi : comment effectuer la coupe où on voulait.
Déjà, quand j’étais étudiante de troisième cycle dans les années 1980, des gens réfléchissaient à une manière de le faire. J’étais au Massachusetts General Hospital lorsque Jim Gusella a cartographié la mutation à l’origine de la maladie de Huntington, une maladie neurologique mortelle. Et tout le monde pensait : « D’accord, maintenant nous connaissons le gène, mais comment allons-nous le réparer ? » Il y avait toutes sortes d’idées : « Et si nous utilisions un produit chimique pour le briser ? Ou un autre tronçon d’ADN pour le rompre ? »
Lorsque nous avons découvert cette protéine dans le système immunitaire bactérien, ce n’était pas ce que nous cherchions, bien entendu. Pourtant, dès que nous avons compris comment elle fonctionnait, nous avons réalisé que ce serait un incroyable outil pour éditer le génome. Comme nous pouvons la programmer avec ce tout petit morceau d’ARN, nous pouvons créer une rupture où nous le souhaitons.
« Pourtant, dès que nous avons compris comment elle fonctionnait, nous avons réalisé que ce serait un incroyable outil pour éditer le génome. »
DC Comment l’amener au bon endroit, dans les bonnes cellules ?
JD Ah oui ! C’est une problématique très importante dans nos avancées, en particulier pour les thérapies. Pour le moment, nous le faisons de manière rudimentaire : nous pouvons stimuler les cellules électriquement ou les traiter chimiquement pour qu’elles récupèrent les molécules ; nous pouvons aussi accrocher la molécule à un anticorps, qui est ensuite reconnu par des molécules spécifiques sur certaines cellules. Cependant, honnêtement, nous ne disposons pas pour l’instant d’une super-méthode pour l’introduire, disons, dans des cellules musculaires, cérébrales, hépatiques ou pulmonaires.
Donc, en termes d’utilisation thérapeutique, un système de distribution est le sujet à la pointe des recherches. Je m’y intéresse de très près et je travaille avec différents collègues pour tenter de le découvrir. Je pense vraiment que les premières thérapies humaines utilisant cette technologie porteront sur le sang ou l’œil, car l’acheminement dans ces deux tissus ne semble pas très problématique. Dans le cas de l’œil, on peut injecter du matériel génétique, et dans le cas du sang, on peut prélever des cellules et les traiter en dehors du corps ; on peut ensuite vérifier que l’édition a été réalisée correctement, cultiver les cellules et les réinjecter au patient.
Dans ces deux cas, le problème de distribution n’est pas trop délicat, mais dans d’autres situations, comme le traitement de la dystrophie musculaire progressive de Duchenne, il reste encore beaucoup à découvrir. Une autre méthode consiste à concevoir des virus capables de repérer les cellules appropriées et de s’y attacher, mais il subsiste des risques à éliminer si elle doit servir chez l’homme.
Nous savons que, dans le principe, cette méthode peut fonctionner in vitro, avec modification extracorporelle des cellules, mais il faut avoir conscience qu’elle a déjà servi à traiter et guérir des animaux. Chez la souris par exemple, nous savons que cela fonctionne, mais l’adapter à l’homme en l’employant en toute sécurité est une étape supplémentaire, et pas des moindres.
[Depuis cet entretien, plusieurs laboratoires ont fait état de l’utilisation d’un système de distribution viral pour corriger la mutation de Duchenne chez la souris.]
DC La technologie va-t-elle devenir fiable au point qu’on écartera les questions actuelles sur les organismes génétiquement modifiés ?
JD Oui, c’est en chemin. Nous n’y sommes pas encore, mais la technologie est en chemin. C’est un outil vraiment précis. Au lieu de demander à un virus de s’introduire aléatoirement dans un génome et de libérer un nouveau gène (ce que faisait la thérapie génique à l’origine, par exemple), nous programmons maintenant une enzyme afin qu’elle aille à un endroit spécifique d’un ADN cellulaire pour y effectuer une ou plusieurs coupes. Il est ensuite possible d’effectuer un changement ou un remplacement des informations, très précisément. Bientôt nous pourrons le faire avec une extraordinaire exactitude et une incroyable efficacité. C’est pourquoi tout le monde est tellement enthousiaste. C’est un changement profond dans notre manière de penser et de pratiquer la biologie. Cela fait partie du nouveau paysage.
DC Cas9 est une protéine, donc il doit exister un gène correspondant. Des bactéries portent ce gène. Le portons-nous aussi ?
JD Non, pour autant que nous le sachions. Les cellules eucaryotes [cellules dont le noyau contient l’ADN] n’en contiennent apparemment pas, ou bien nous ne l’avons pas encore trouvé, tout simplement. Si elles n’en étaient pas porteuses, cela ne serait pas surprenant. Sans doute parce que les systèmes immunitaires de nos cellules sont beaucoup plus élaborés : notre système immunitaire inné combat les virus grâce à un ensemble de protéines, et notre système adaptatif génère des anticorps, donc nous n’en avons peut-être pas besoin.
DC C’est valable dans une créature multicellulaire, mais tous nos problèmes commencent par une cellule. Un cancer débute avec une seule cellule, donc s’il existait un mécanisme réparateur. […]
JD Oui, mais il faudrait que la cellule sache qu’elle a subi une mauvaise mutation, puis qu’elle soit capable de la réparer. « Savoir » va être le point épineux. Mais guettez les infos !
DC Avez-vous été étonnée par l’intensité des activités au sein de la cellule ?
JD Je suis étonnée tous les jours. C’est l’une des joies d’être une scientifique. Nous, les êtres humains, sommes des créatures fascinantes, comme la façon dont les cellules grandissent, se divisent et s’organisent. […] Je ne sais jamais à quoi m’attendre. Qui savait que Cas9 existait et faisait tout cela ? Le processus scientifique, c’est un peu comme peler un oignon : on retire une épaisseur et puis on réalise qu’il y en a cinq autres dessous. Des strates et des strates de contrôles rien que dans le génome, par exemple. Mais on ne parle pas seulement de gènes qui codent pour une protéine, vous comprenez ? Il y a aussi la régulation de ces gènes, toutes les altérations chimiques effectuées sur l’ADN, ainsi que la mobilité et la plasticité de l’ADN. Tout cela est passionnant.
DC En imaginant l’avenir de l’édition génique, pensez-vous qu’il se heurtera à des interdits scientifiques ou éthiques, si les mauvais côtés excédaient de trop les bons ?
JD Je suis une scientifique et je crois qu’il est important de disposer de données pour prendre des décisions, en particulier sur ce genre de chose. Mais je pense effectivement que les expériences (notamment sur l’homme, l’animal ou l’embryon humain) doivent être effectuées dans un cadre approprié afin d’éviter les abus. Cela fait partie de notre nature humaine de vouloir instaurer des règles ou des consensus pour que la société soit à l’aise avec telle ou telle manière d’agir. La difficulté, pourtant, est que la science est mondialisée, que des sociétés et des cultures différentes ont des critères différents pour réfléchir à ces questions. Donc je ne sais pas si nous allons arriver au point où les habitants de la planète pourront dire qu’ils sont tous d’accord pour faire X et Y, mais pas pour faire A et B.
« La science est mondialisée, des sociétés et des cultures différentes ont des critères différents pour réfléchir à ces questions. »
Cependant, à mon avis, dans certains domaines de compétence, et sans doute dans les communautés cliniques et scientifiques dominantes (au moins aux États-Unis et en Europe – peut-être aussi en Asie, on verra), il y aura un consensus sur la façon de procéder dans le respect de la vie humaine, et la plupart des gens seront à l’aise avec ce qui sera entrepris.
Le changement prend toujours du temps. Vous et moi sommes de la même génération, nous sommes assez âgés pour nous rappeler la généralisation de la fécondation in vitro (FIV). Il y a eu beaucoup de polémiques pour savoir si c’était une bonne chose ; je me souviens des débats dans ma famille, de mes parents qui s’interrogeaient : « Est-ce que c’est bien ? Les gens devraient-ils vraiment pouvoir faire ça ? » Mais avec le temps, les gens se sont habitués ; ils ont découvert que les bébés nés ainsi étaient en bonne santé et faisaient la très grande joie de leurs parents. Ces enfants étaient source d’un immense bonheur. Est-ce une mauvaise chose ? Certains peuvent dire que jamais ils n’en voudraient, tandis que d’autres diraient que les FIV sont une chose merveilleuse.
En arriverons-nous un jour au point où il paraîtra contraire à l’éthique de ne pas utiliser l’édition génomique dans certaines applications ? C’est une possibilité, même à propos de l’édition de la lignée germinale, mais nous n’en sommes pas là aujourd’hui. Nous ne disposons pas encore des études nécessaires pour comprendre comment l’édition des gènes fonctionnerait chez l’homme.

