¿Quiere cambiar su ADN?
La bioquímica Jennifer Doudna aborda el tema de la tecnología de punta en ADN que permite la edición del genoma humano. Esto también se suma a una creciente lista de problemas éticos de la actualidad a los que se enfrentan los investigadores.
Habiendo crecido en la Isla Grande de Hawai, Jennifer Doudna se acostumbró a ver la gran curva del horizonte y el vasto cielo que envuelve este diminuto mirador en medio del océano. Es esa una vista que puede resultar intimidante en escala, pero también invitante en posibilidades: uno se encuentra prácticamente perdido en el espacio; y aun así, todo se encuentra allí, al borde, bajo la superficie, a sus pies. Constituye así una imagen apropiada para ilustrar el descubrimiento por el cual mejor se conoce a Doudna. En el interior de la más diminuta de las células bacterianas, ella y su equipo descubrieron una puerta de acceso a todo un mundo nuevo: dentro de la química por la cual las bacterias pueden recordar y cortar el ADN proporcionado por los virus infecciosos, ella encontró una herramienta para editar los genes.
Aunque las moléculas que cortan el ADN (llamadas enzimas de restricción) se habían conocido por décadas, esto era algo nuevo: una enzima con la que se podría programar dónde cortar. Casi como surgiendo de la nada, este descubrimiento ha abierto de par en par una nueva ventana en la ingeniería genética a un nivel de precisión y exactitud nunca antes alcanzado.
En su artículo del 2012 publicado en la revista Science, Doudna y sus colaboradores en la investigación sugerían lo siguiente: «Proponemos una metodología alternativa basada en la Cas9 programada por ARN que podría ofrecer un considerable potencial para las aplicaciones de la modificación genética dirigida y la edición genómica».
Conocido como CRISPR-Cas9 (o simplemente «crisper»), este sistema en verdad ha revolucionado el mundo de la ingeniería genética. Como señala un reciente artículo de revisión, «CRISPR se ha convertido rápidamente en la herramienta preferida para la manipulación genética y se muestra increíblemente prometedora como plataforma para estudiar la función génica in vivo».
«Me entusiasma el potencial de la ingeniería genómica de causar un impacto positivo en la vida humana y en nuestra comprensión fundamental de los sistemas biológicos», dice Doudna, pero ¿cuál es el mejor camino para avanzar en este mundo nuevo?
«Para lograr suscitar más confianza en la ciencia es mejor animar a la gente interesada en la génesis de una tecnología a participar activamente en debates sobre sus usos. Esto es especialmente importante en un mundo donde la ciencia es global, los materiales y reactivos se distribuyen a través de proveedores principales, y es más fácil que nunca tener acceso a datos publicados».
Doudna es profesora de bioquímica, biofísica y biología estructural en la Universidad de California en Berkeley. En su oficina en el campus de Berkeley, habló con Dan Cloer, colaborador de Visión.
DC ¿Qué está en juego cuando hablamos sobre edición de la línea germinal? ¿Cómo afectó sus impresiones la Cumbre Internacional sobre Edición Genética Humana de diciembre de 2015?
JD Pensar en esto es realmente fantástico. Uno de pronto se da cuenta de que… «¡Caramba, tenemos una herramienta que en principio nos permite cambiar la evolución humana! Podemos eliminar una mutación de la población entera: deshacernos de ella (de la mutación)».
Por supuesto, hay aspectos científicos prácticos y realidades de la reproducción humana, así que no vamos a hacer nada de la noche a la mañana. Pero es evidente que tenemos las herramientas para cambiar nuestro ADN y con ello lo que estamos transmitiendo a las generaciones futuras. Y ahora podemos nosotros hacer esas decisiones. Este es un profundo pensamiento.
«Tenemos las herramientas para cambiar nuestro ADN y con ello lo que estamos transmitiendo a las generaciones futuras. Y ahora podemos nosotros hacer esas decisiones».
El reciente encuentro no cambió estas impresiones, sino que las amplió. Soy una persona de mente muy abierta y trato de aprender y comprender. Conozco la ciencia porque soy científica, pero trato de comprender toda otra opinión al respecto. La cumbre fue interesante porque hemos escuchado a varios expertos en bioética y gente que está trabajando con pacientes y familias con enfermedades genéticas. He alternado con gente que tiene estas enfermedades, con padres desesperados que buscan ayuda. Yo soy madre, de modo que puedo comprender cabalmente sus deseos.
La cumbre logró un objetivo importante, que fue reunir a las partes interesadas; no solo a científicos, sino —aunque no a todos— a personas de otros ámbitos; fue un comienzo. Así que se expresaron muchas opiniones, y eso fue lo estupendo. En general, se coincidió en que la investigación debe seguir, pero queremos proceder con la debida cautela. Es por esto que nuestra declaración al final de la reunión aspira a un amplio consenso social antes de usar esta tecnología en alguna aplicación clínica en la línea germinal humana. ¿Pero cómo define uno lo de «amplio consenso social»? Esto está por verse; no fue el fin de la conversación, sino el comienzo.
DC Al final de la cumbre se debatió sobre el lenguaje, la necesidad de un glosario para facilitar el acceso a la información por parte de los observadores legos. Tuve la sensación de que las «luminarias» (como David Baltimore se refiriera a los conferenciantes y a la audiencia) eran los adultos en la sala, y el resto de nosotros niños que necesitábamos que se nos enseñara o guiara a alguna conclusión. ¿Puede el público entender lo que necesita saber?
JD Me da algo de tristeza esta pregunta. Ciertamente, no me siento de ese modo y lamento que tuviera esa impresión. Somos todos personas que vivimos juntas en la misma sociedad y en el mismo planeta. Sí, algunos de nosotros tenemos conocimientos especializados en materia de ciencia y otros en otras cosas, pero todos somos importantes para este debate. Yo soy tan estudiante en otros campos del saber, como quienes de entre los que en ellos están pudieran ser estudiantes de ciencias. Yo quiero participar en la conversación, no dictar o decirle a otra gente lo que debe pensar. Con todo, la realidad es que los científicos tenemos cierta base de conocimiento.
El problema es cómo comunicar esa información a personas que no son expertos técnicos. La ciencia es en buena medida un lenguaje, y nosotros nos apegamos a nuestros acrónimos. Creo que es crucial que los científicos participemos en estas conversaciones, pero necesitamos que los demás también participen. Quiero personas que piensen sobre esto desde una posición educada para entender la ciencia lo suficientemente bien, a fin de que puedan decidir cómo se sienten realmente al respecto. Quiero asegurarme de que, como científica que participa en esto, estoy haciendo mi parte para brindar educación, para explicar qué es esto de modo que la gente pueda pensar al respecto desde una perspectiva informada. No quiero decirles cómo pensar; quiero decirles: «Esto es lo que está pasando. Ahora, decidan ustedes».
DC En un artículo en la revista Nature usted escribió lo siguiente: «El rápido desarrollo y la adopción generalizada de metodologías de edición genómica fáciles de usar, económicas y eficaces han cambiado el paisaje de la biología». Dado que para la persona lega esto es extremadamente complejo, ¿podría decirnos qué, en esencia, significa?
JD Significa que ahora tenemos una herramienta que permite reescribir el código genético, cambiando el ADN de las células. Eso es algo profundo. Permite a los científicos hacer cosas que en el pasado habrían resultado sumamente difíciles o imposibles. Cuando pienso en el «paisaje de la biología», pienso en todo; no solo en la biología humana y en la medicina, sino en la biología de las plantas, los hongos, el mundo bacteriano. Es un lugar enorme.
DC ¿Hay también aquí una zona oscura? ¿Cuán fácil sería generar una superbacteria?
«Si lo que le preocupa a la gente es el bioterrorismo, hay formas muchísimo más fáciles que esta para causar problemas».
JD Podría hacerse con dificultad; pero si un terrorista procura causar daños, tiene maneras de hacerlo muchísimo más fáciles que esta. Esto no es algo que me preocupe demasiado. Cuando nosotros lo describimos como «una herramienta simple y fácil de usar» hablamos en términos relativos. Si uno es biólogo molecular, sí le resultará más simple y más fácil de usar; pero para la persona común y corriente no es así. Si lo que le preocupa a la gente es el bioterrorismo, hay formas muchísimo más fáciles que esta para causar problemas.
DC Hace cincuenta años, a partir de los términos alquimia y gen, se acuñó el término algenia, que suponía un cierto escepticismo acerca de lo que podríamos lograr realmente al alterar la genética. ¿Estamos demasiado enamorados de los genes? ¿Dónde estamos en cuanto a entender su fuerza determinista?
JD Este va a ser un objetivo móvil. Hoy en día sabemos de un conjunto de genes que causan trastornos monogénicos específicos (por ejemplo —entre los derivados de un solo gen defectuoso— la enfermedad de Tay-Sachs, la anemia de células falciformes, la fibrosis quística, la hemofilia, etc.). Si fuéramos capaces de arreglar o reparar esas mutaciones en pacientes, sabemos que esto les proporcionaría profundos beneficios a esos pacientes. Extendernos más allá, a enfermedades mucho más complejas, como la esquizofrenia, el trastorno del espectro autista u otras donde intervienen muchos genes (tal vez cientos de genes o más, donde cada uno puede contribuir un poquito) será difícil. ¿Cómo se le ocurriría a uno usar el método de edición genómica en estos casos? No lo sé. ¿Sería siempre apropiada la edición génica? En verdad, aún no hemos llegado a esta conclusión, y tal vez nunca lleguemos.
Hay muchas otras clases de cosas de cuya base genética subyacente no tenemos ni idea. Pero yo pienso que en el futuro dispondremos de más conocimiento. No me he fijado un plazo, pero creo que las tecnologías de edición genómica contribuirán a esa comprensión fundamental. A medida que avancemos, seremos capaces de diseccionar la genética de otros rasgos y enfermedades. Pero hasta la fecha, si alguien realmente quisiera tener un hijo más alto o más listo con este nivel de inteligencia, no es como si pudiéramos marcar eso en el genoma.
DC Este tipo de mejoras genera otra serie de cuestiones, pero en relación con la enfermedad monogénica las cuestiones son aparentemente más simples y se pueden tratar.
JDPor cierto, no se resuelven todos los problemas; pero si este es el suyo, entonces es enorme. Mi investigación es sobre la tecnología de edición génica y también sobre los sistemas inmunes bacterianos. Colaboramos con profesionales clínicos con respecto al uso de la tecnología para tratar de entender la base genética de ciertas enfermedades y esperamos que, en el futuro, esto realmente sea de beneficio para los pacientes. Yo no soy doctora en medicina, así que no me ocupo en actividades clínicas, pero quiero habilitar a quienes lo hacen. Todos estos son tratamientos de células somáticas adultas, no de líneas germinales.
«Por cierto, no se resuelven todos los problemas; pero si este es el suyo, entonces es enorme».
Yo quiero participar en el debate general sobre esto; no voy a tirar todo por la borda y dejar que la gente se las arregle sola. Cabe decir que formo parte de esta conversación y me siento responsable.
DC ¿Cuál fue su contribución al descubrimiento de CRISPR Cas9? ¿Cómo opera la edición génica?
JD El proyecto CRISPR se dio a raíz de una colaboración entre Emmanuelle Charpentier y yo en Alemania. Nos unimos para averiguar la función molecular de una proteína particular llamada Cas9, que opera en el sistema inmune bacteriano. Nuestra investigación develó el hecho de que esta era una proteína guiada por una molécula de ARN.
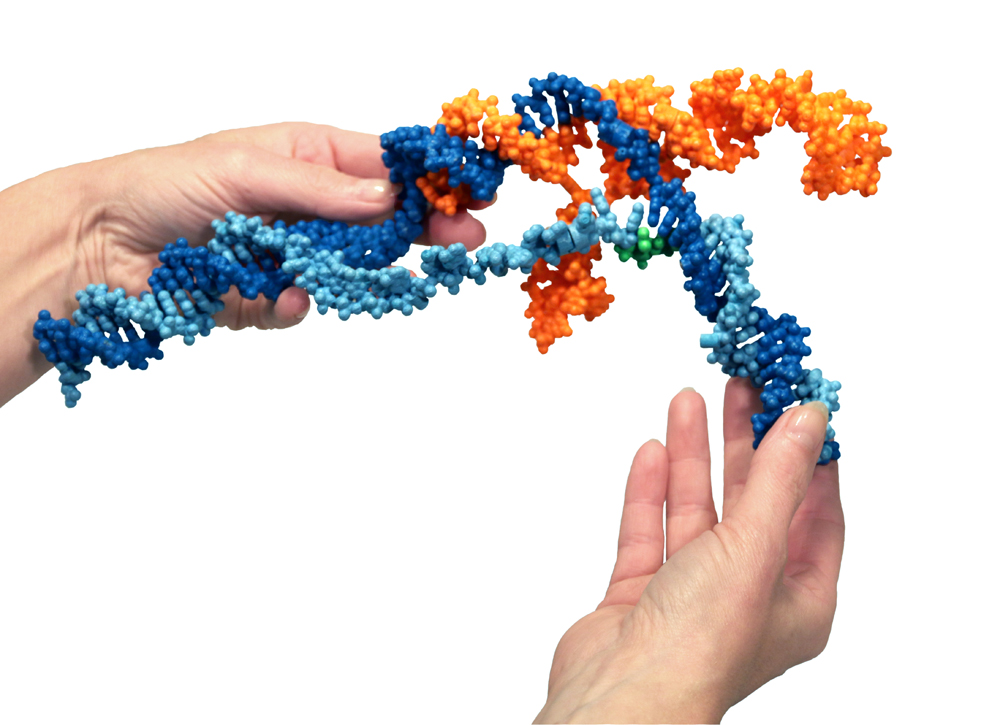
Esta maqueta especial de yeso y nylon del Sistema CRISPR-Cas9 fue diseñada e impresa por 3D Molecular Designs en colaboración con Jacob Corn, PhD, director científico de la Innovative Genomics Initiative (Iniciativa de Genómica Innovadora).
Foto: Shannon Smith, 3D Molecular Designs
Tenemos aquí una maqueta. La proteína se une con una molécula de ARN (naranja). La molécula de ARN se asienta en la proteína. Juntas recorren el ADN (azul) de la célula en busca de una concordancia entre las letras genéticas del ADN y las del ARN. Es así como el ARN resulta ser un «guía» en el sistema; busca una secuencia específica de ADN. Cuando se encuentra una concordancia entre la secuencia de 20 letras del ARN y un segmento del ADN, la doble hélice del ADN se abre (la hebra celeste se separa de la hebra azul y se forma la hélice ARN-ADN, oculta dentro de la proteína). Entonces, las «cuchillas» moleculares de la proteína cortan las dos hebras del ADN. Se logra un corte muy preciso, como efectuado con un bisturí; la escalera de ADN se corta transversalmente. Para las bacterias, esta es una manera de contrarrestar una infección viral.
Otra maquinaria en la célula repara la ruptura. Cuando la reparación se lleva a cabo, ocurre la edición real del ADN y se puede cambiar la secuencia. Cas9 es la tijera, pero luego hay que pasar el ADN cortado a otras proteínas de la célula que catalizan la recombinación. Estas enzimas reparadoras pueden encontrar el ADN para suturarlo, lo cual puede facilitar el experimentador.
Estas moléculas reparadoras se conocen desde hace tiempo. Entonces, la idea era que si se pudiera encontrar la forma de romper el ADN en un lugar particular donde se quisiera inducir un cambio, uno podría controlar la manera en que la reparación ocurra. Ese era el reto: cómo hacer el corte donde uno quiere.
Ya en la década de los ochenta, cuando yo estaba en la universidad, había quienes pensaban en cómo hacer esto. Yo estaba en el Massachusetts General Hospital cuando Jim Gusella trazó la mutación que causa la enfermedad de Huntington (Corea de Huntington o Baile de San Vito), una enfermedad neurológica fatal. Y todo el mundo pensaba, Bien, ahora conocemos el gen, pero ¿cómo lo arreglamos? Surgían diversas ideas: ¿Qué si tuviéramos un químico que pudiera romperlo? ¿O usar otro trozo del ADN para romperlo?
Cuando encontramos esta proteína en el sistema inmune bacteriano, no estábamos buscando eso, claro está; pero en cuanto comprendimos cómo funcionaba, nos dimos cuenta de que esta sería una herramienta increíble para la edición genómica. Dado que podemos programarla con este trocito de ARN, podemos hacer una ruptura donde queramos.
«En cuanto comprendimos cómo funcionaba, nos dimos cuenta de que esta sería una herramienta increíble para la edición genómica».
DC ¿Cómo la encamina hacia el lugar correcto, las células adecuadas?
JD Ah sí, de cara al futuro, esto representa un reto muy importante, especialmente para las terapias. En la actualidad, la forma en que lo hacemos es algo primitiva: Podemos estimular las células eléctricamente o tratarlas químicamente para adquirir las moléculas. Podemos conectar esto a un anticuerpo que entonces es reconocido por moléculas específicas en ciertas células. Pero francamente, no tenemos actualmente una forma estupenda de introducir esto en —digamos—, células de los músculos, el cerebro, el hígado o los pulmones.
Así que, en términos de usar esto a manera de terapia, un sistema de transferencia está en la vanguardia del campo. A mí me interesa muchísimo y estoy trabajando con varios colegas para tratar de descifrarlo. Pienso que las primeras terapias humanas que habrán de usar esta tecnología serán las que traten con la sangre o los ojos, dado que la transferencia en esos dos tejidos no parece ser tan problemática. En el ojo, se puede inyectar material, y en la sangre, se pueden quitar las células del cuerpo y tratarlas fuera de él. Luego se puede verificar que la edición se llevó a cabo correctamente, madurar las células y reintroducirlas en el paciente.
En esas dos situaciones, el problema de la transferencia no es tan grande, pero en otras situaciones, como por ejemplo, al tratar la distrofia muscular de Duchenne, hay todavía mucho por averiguar. Usar virus diseñados que puedan localizar las células adecuadas y adherirse a ellas constituye otro método, pero hay riesgos que es necesario superar si se ha de aplicar en humanos.
Sabemos que, en principio, esto puede funcionar in vitro —cambiando las células fuera del cuerpo—, pero es importante apreciar que ya se ha usado para tratar y curar enfermedades en animales. En ratones, por ejemplo, sabemos que funciona, pero trasladarlo a humanos y utilizarlo con seguridad supone un gran paso.
(Desde el momento de esta entrevista, varios laboratorios han informado del uso de un sistema de transferencia viral para corregir la mutación de Duchenne en ratones).
DC ¿Se volverá tan precisa esta tecnología que los actuales problemas de OMG (organismos modificados genéticamente) dejarán de ser tales?
JD Sí, eso está por ocurrir. No ha llegado aún a ello, pero la tecnología está en camino. Esta es una herramienta realmente precisa. En vez de requerir que un virus se integre aleatoriamente en un genoma y transfiera un nuevo gen (de la manera en que la terapia génica original se hacía, por ejemplo), ahora nosotros programamos una enzima para que vaya a un lugar específico del ADN de la célula y haga uno o más cortes. Entonces, de manera muy precisa, se puede efectuar el cambio o reemplazo de la información. Pronto podremos hacer eso con suma precisión e increíble eficacia. De ahí que estemos todos tan entusiasmados. Este es un cambio profundo en lo que respecta a la manera en que pensamos y actuamos en biología. Es parte de un nuevo paisaje.
DC Cas9 es una proteína, así que debe haber un gen para ella. Las bacterias tienen ese gen. ¿Lo tenemos también nosotros?
JD No, no hasta donde sabemos. Las células eucariotas (células con un núcleo que contiene el ADN) no parecen tenerlo, o nosotros aún no lo hemos encontrado. Pero si no lo tienen, ¿por qué no? Tal vez sea porque nuestras células tienen sistemas inmunitarios mucho más sofisticados. Nuestro sistema de inmunidad innata combate a los virus a través de una serie de proteínas, y nuestro sistema adaptativo crea anticuerpos, así que a lo mejor no necesitamos algo como esto.
DC Esto es cierto en criaturas multicelulares, pero todos nuestros problemas comienzan como células individuales. El cáncer comienza como una célula sola, así que si hubiera un mecanismo de reparación…
JD Sí, pero la célula tendría que saber que tiene una mutación que es perjudicial y, además, ser capaz de arreglarla. «Saberlo» sería lo difícil. ¡Pero manténgase atento!
DC ¿Le ha sorprendido la profundidad de las actividades que ocurren en el interior de la célula?
JD Me sorprende todos los días. Es uno de los gozos de ser científica. Los humanos somos criaturas fascinantes, y la manera toda en que las células crecen, se dividen y se organizan… ¡Nunca sé qué esperar luego! ¿Quién sabía que Cas9 existía y que hacía estas cosas? La ciencia es un proceso similar al de pelar una cebolla. Le quita uno una capa, y se da cuenta de que «¡Oh, había cinco más debajo!». Capa tras capa de controles en tan solo el genoma, por ejemplo. No se trata de solo genes que codifican una proteína, ¿cierto? Es acerca de cómo esos genes se regulan, y todas las modificaciones químicas que se le hacen al ADN, y la movilidad y plasticidad del ADN. Todo esto es sumamente interesante.
DC Al imaginar el futuro de la edición génica, ¿encuentra algo científica o éticamente fuera de lugar, donde en comparación con los beneficios los costos resulten demasiado altos?
JDYo soy científica y creo que para hacer decisiones es importante tener información, especialmente sobre asuntos como este. Pero pienso que los experimentos —particularmente con humanos, animales o embriones humanos— se deben hacer con lineamientos adecuados establecidos para evitar el abuso. Es parte de nuestra naturaleza humana querer tener reglamentos o acuerdos consensuados en vigor, a fin de que la gente proceda del modo que sea más cómodo para la sociedad. No obstante, el problema consiste en que la ciencia es mundial, y las distintas sociedades y culturas tienen normas diferentes con respecto a lo que opinan sobre estos asuntos. Así que no sé si habremos de llegar a un punto en el que todos en el planeta podamos decir que estamos de acuerdo en que podemos hacer X e Y, pero no A y B.
«La ciencia es mundial, y las distintas sociedades y culturas tienen normas diferentes con respecto a lo que opinan sobre estos asuntos».
Pero pienso que dentro de estas jurisdicciones y probablemente dentro de las comunidades principales científicas y clínicas (al menos, en los Estados Unidos y en Europa, y tal vez en Asia también) habrá un consenso acerca de cómo proceder de tal manera que sea respetuosa de la vida humana y que la mayoría de la gente se sienta cómoda de seguir avanzando.
Los cambios siempre toman tiempo. Usted y yo somos de la misma época, lo suficientemente mayores como para recordar cuando la fertilización in vitro (FIV) se puso al alcance de todos por primera vez. Hubo mucha controversia acerca de si estaba bien o no hacer eso. Yo recuerdo debates en el seno de mi familia; mis padres preguntándose «¿Está bien eso? ¿Debería la gente realmente poder hacer eso?». Pero con el correr del tiempo, la gente se acostumbró a ello; vieron que los bebés nacidos de ese modo eran sanos, y que hacían muy felices a sus padres. Esos bebés trajeron indecible gozo. ¿Es malo eso? Mientras unos pudieran decir: «¡Yo jamás me prestaría a eso!», otros dirían «¡La FIV es algo maravilloso!».
¿Llegaremos alguna vez al punto de decir que pudiera ser inmoral no usar la edición genómica para ciertas aplicaciones? Esta es una posibilidad hasta para la edición de la línea germinal, pero hoy no estamos allí; no tenemos aún los estudios para comprender cómo la edición génica funcionaría en situaciones humanas.

